LA TABLA PERIODICA - HISTOIA
Durante el siglo XIX, los químicos comenzaron a clasificar los elementos conocidos de acuerdo con similitudes en sus propiedades físicas y químicas. El final de esos estudios generó la Tabla Periódica Moderna que conocemos.
Entre 1817 y 1829, el químico alemán Johan Dobereiner clasificó a algunos elementos en grupos de tres denominados triadas, ya que tenían propiedades químicas similares. Por ejemplo, en la triada cloro (Cl), bromo (Br) y yodo (I) notó que la masa atómica de Br estaba muy próxima al promedio de la masa de Cl e I. Desafortunadamente no todos los elementos se agrupaban en triadas y sus esfuerzos fallaron para proponer una clasificación de los elementos.
En 1863, el químico inglés, John Newlands clasificó los elementos establecidos en varios grupos proponiendo la Ley de Octavas, conformado por elementos de masa atómica creciente, donde ciertas propiedades se repetían cada 8 elementos.
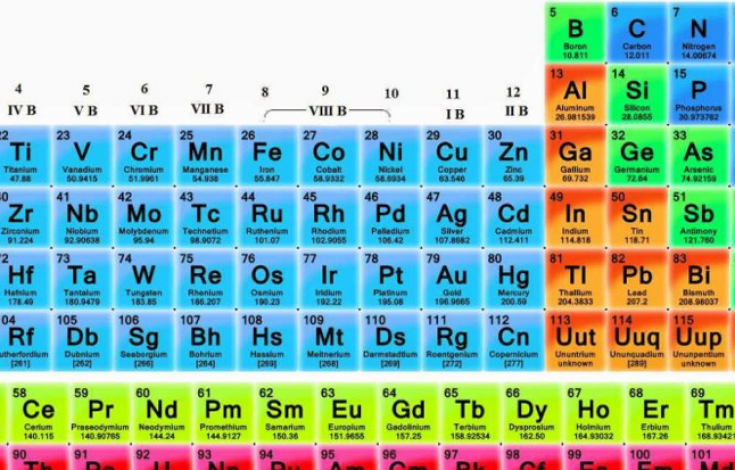
SISTEMA PERIODICO
|
|
|
|
|
|
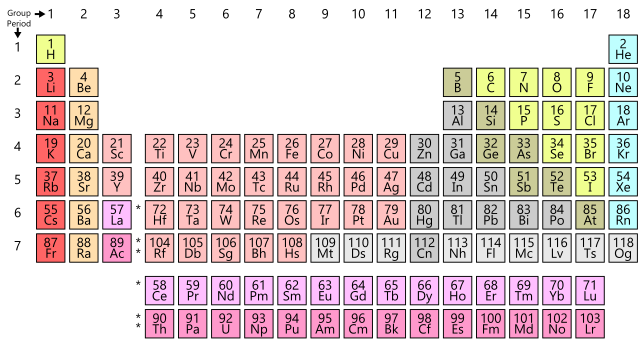
Solo un el símbolo Z. El número atómico identifica inmediatamente el elemento, ya que es único para cada elemento. Siempre es un núelemento puede ocupar una posición concreta en una tabla periódica. A cada elemento se le asigna un número en cada posición. Este número, llamado número atómico, ahora va desde el 1 para hidrógeno al 118 para el oganesón (Og). Se le asigna mero entero y suele aparecer en la parte superior de la cuadrícula de cada elemento en la mayoría de las tablas periódicas actuales . Por lo tanto, cuando alguien se refiere al elemento Z = 3, inmediatamente sabemos que se están refiriendo al elemento litio; El elemento 6 es carbono, el 79 oro, y así todos. |
|
 |
